物理热力学第一定律,△U=W+Q
△U,系统的内能的变化量。W,外界对系统做的功。Q,系统吸收的热量。在热力学中系统发生变化时,设与环境之间交换的热为Q(吸热为正,放热为负),与环境交换的功为W(环境对系统做功为正,系统对环境做功为负),可得热力学能(亦称内能)的变化为△U=Q+W
恒压过程△H=Q
- 什么是热力学能(内能)
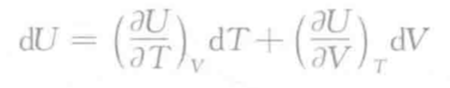
- 什么是焓H
- 体积功
对体积连续变化的过程,膨胀功为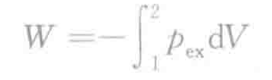
pex为外压。负号表示环境做负功。
理想气体恒温可逆膨胀过程,有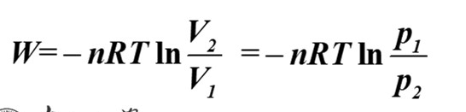
推导:pdV积分,p等同于nRT/V
外界对气体做负功,气体吸热,△U=0,△H=0
- Cp与Cv的关系
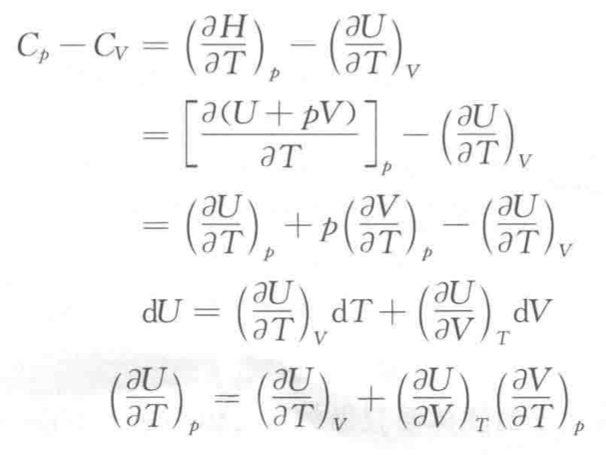
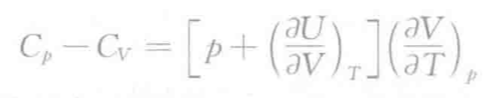
- 热力学第一定律应用
以下两公式对封闭体系、无其它功(电磁……)、无化学变化、无相变化的理想气体单纯pVT变化过程全都适用
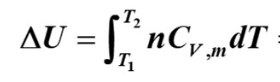
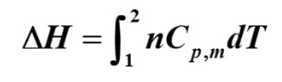
单原子分子理想气体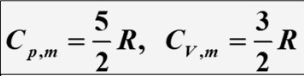
双原子分子理想气体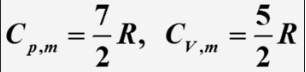
- 理想气体绝热过程
绝热可逆过程方程
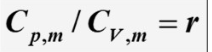

绝热可逆/非可逆体积功W
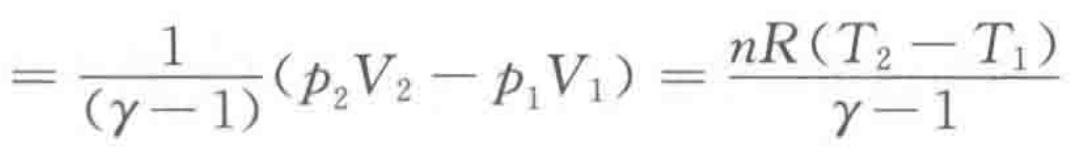
- 焓的计算
dH=dQ+dW+d(pV)=dU+pdV+Vdp --在此可应用pV=nRT - 焦耳-汤姆逊实验
等焓过程。
焦耳-汤姆逊系数。
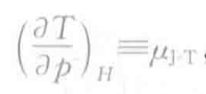
- 基尔霍夫定律-反应热与温度的关系
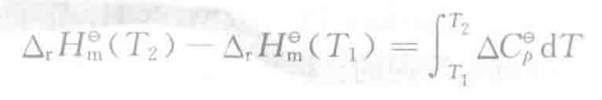
等式右边是产物减反应物的恒压热容之和。